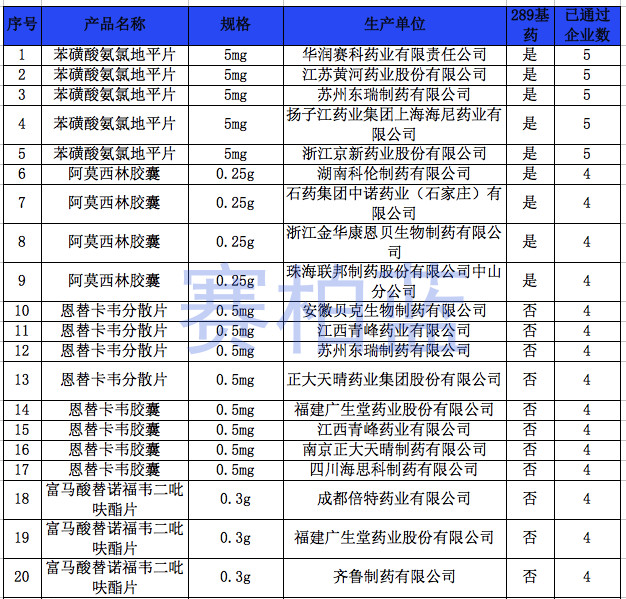
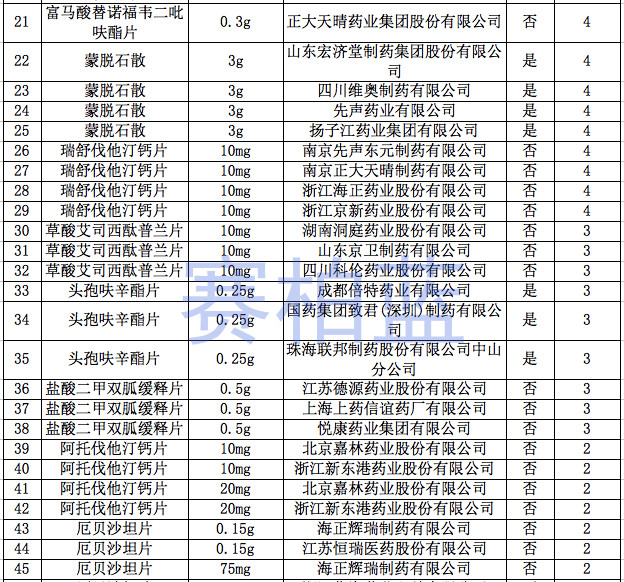
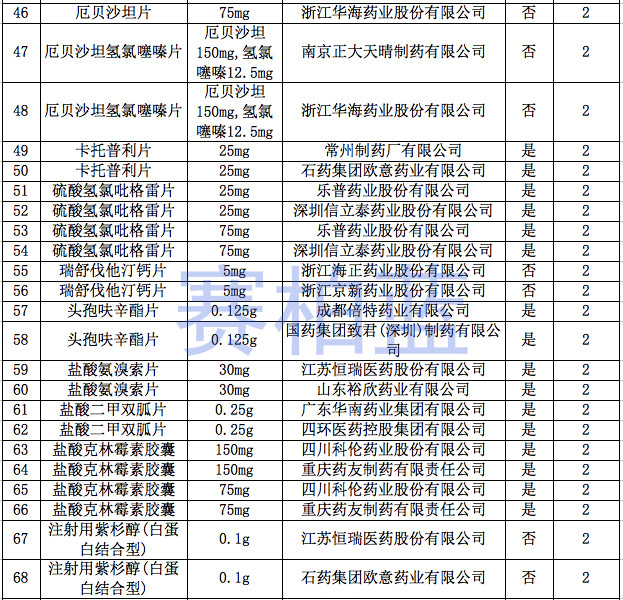
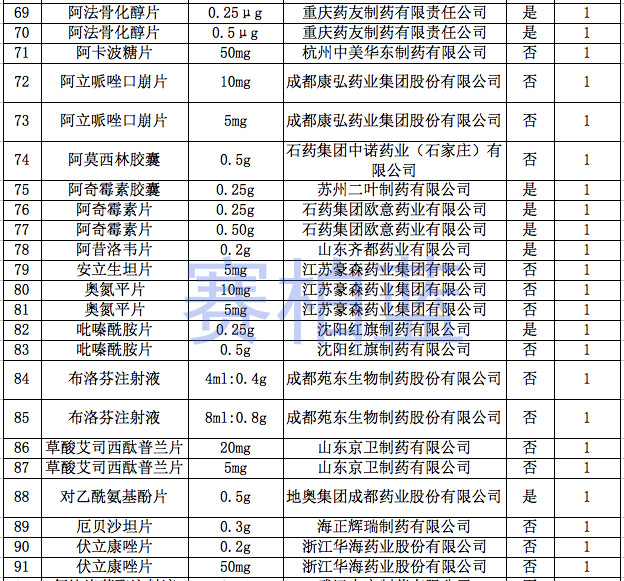
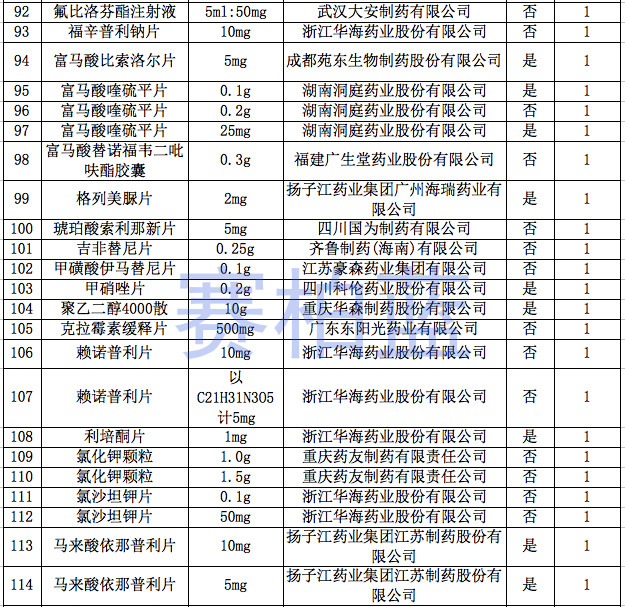
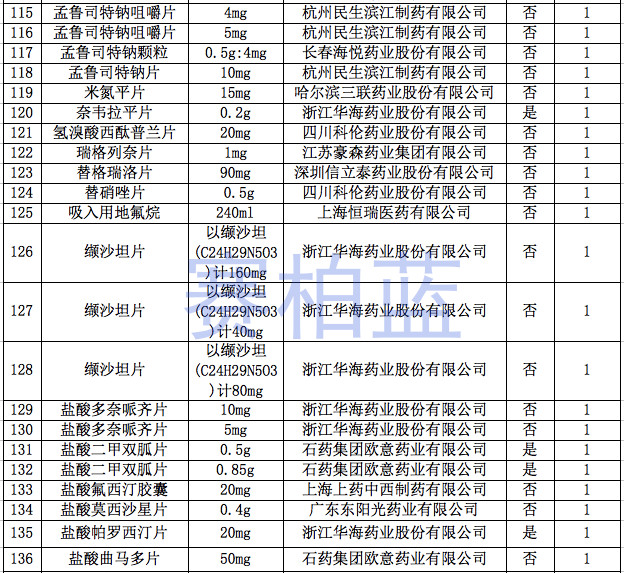
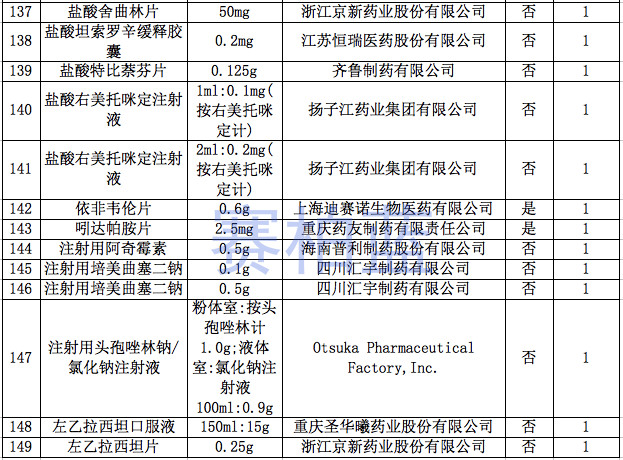
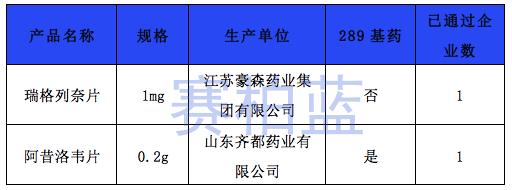
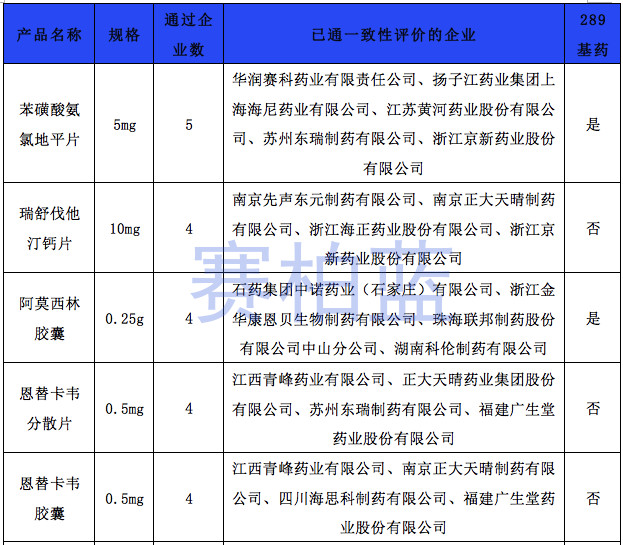
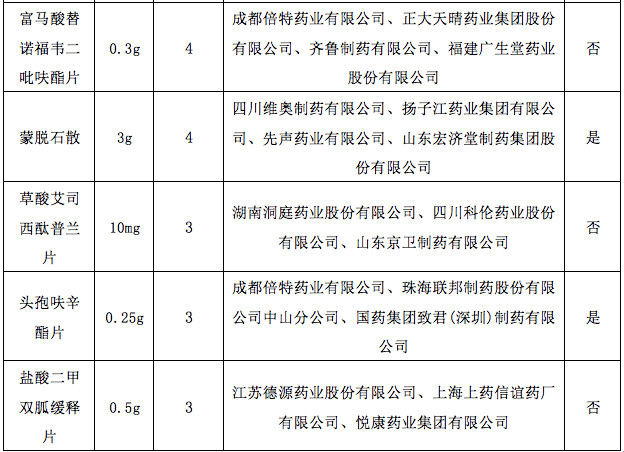
 据赛柏蓝统计,截至目前,已有149个产品通过或视同通过一致性评价,属于& 289目录& 的只有55个产品,共涉及26个品种。
在通过或视同通过一致性评价的产品中,有10个品种是已满3家企业的。具体如下:
据赛柏蓝统计,截至目前,已有149个产品通过或视同通过一致性评价,属于& 289目录& 的只有55个产品,共涉及26个品种。
在通过或视同通过一致性评价的产品中,有10个品种是已满3家企业的。具体如下:
 ▍一致性评价,大限仍在
在2018年的最后几天,国家药监局正式发文,明确一致性评价年末大限延期,但是必须要注意的是,大限仍在。
国家药监局明确要求,化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。
随着通过一致性评价的品种越来越多,首家过评后的三年期限,对于很多企业来说压力也越来越大。
说到一致性评价,那些与一致性评价相关联的政策,也让众多药企措手不及。
根据《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
目前,包括江苏、江西、黑龙江、广西等地已相继发布未通过一致性评价暂停采购的通知,已有多个药品被暂停采购。
除以上省份外,据赛柏蓝统计,截至目前,浙江、湖南、福建、天津、河北、吉林、辽宁、陕西、甘肃等多省市,也已相继发文明确对未过一致性评价药品暂停采购。
此外,国家带量采购对医药行业影响也是巨大的。从国家带量采购第一批清单流出,到4+7城市带量采购中选结果公布,医药板块经历了多次大震荡。
在4+7城市带量采购中,采购的品种也只是原研药、通过或视同通过一致性评价的药品,未通过一致性评价的药品,连申报的机会都没有。
虽然很难,压力很大,但是一致性评价势在必行。为了将来更好的发展,这是所有仿制药企业都必须走的路。
附:149个通过一致性评价的品种汇总(截至1月6日)
▍一致性评价,大限仍在
在2018年的最后几天,国家药监局正式发文,明确一致性评价年末大限延期,但是必须要注意的是,大限仍在。
国家药监局明确要求,化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。
随着通过一致性评价的品种越来越多,首家过评后的三年期限,对于很多企业来说压力也越来越大。
说到一致性评价,那些与一致性评价相关联的政策,也让众多药企措手不及。
根据《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
目前,包括江苏、江西、黑龙江、广西等地已相继发布未通过一致性评价暂停采购的通知,已有多个药品被暂停采购。
除以上省份外,据赛柏蓝统计,截至目前,浙江、湖南、福建、天津、河北、吉林、辽宁、陕西、甘肃等多省市,也已相继发文明确对未过一致性评价药品暂停采购。
此外,国家带量采购对医药行业影响也是巨大的。从国家带量采购第一批清单流出,到4+7城市带量采购中选结果公布,医药板块经历了多次大震荡。
在4+7城市带量采购中,采购的品种也只是原研药、通过或视同通过一致性评价的药品,未通过一致性评价的药品,连申报的机会都没有。
虽然很难,压力很大,但是一致性评价势在必行。为了将来更好的发展,这是所有仿制药企业都必须走的路。
附:149个通过一致性评价的品种汇总(截至1月6日)